两项世界首次:我国科学家从零设计“人工神经开关”,成果登上《细胞》
感谢IT之家网友 的线索投递!
10 月 22 日消息,西湖大学于 10 月 17 日发布博文,宣布其生命科学学院卢培龙研究团队在《细胞》期刊发表重大突破,历时六年实现两项“世界首次”—— 首次实现电压门控阴离子通道的精确从头设计、首次完成人工设计离子通道蛋白的体内实验。
卢培龙研究团队联合李波等校内团队,历经六年攻关,在世界上首次通过“从头设计”的方法,成功创造出一种功能完整、可调控的电压门控阴离子通道(dVGAC)。
这一突破标志着蛋白质设计领域从构建静态结构,迈入了创造能响应外界刺激的动态功能蛋白的新纪元。
IT之家援引博文介绍,离子通道是镶嵌在细胞膜上的蛋白质,如同细胞的“智能门禁”,负责控制离子进出,对神经传导、心跳等生命活动至关重要,从头设计这种复杂的动态蛋白极具挑战。
团队首先利用计算模拟设计出一种由 15 根 α 螺旋构成的五聚体“倒漏斗”形骨架,该结构在自然界中前所未见,为通道的动态开合提供了稳定基础。冷冻电镜技术证实,合成的蛋白质结构与设计模型高度吻合,误差仅为原子级别。
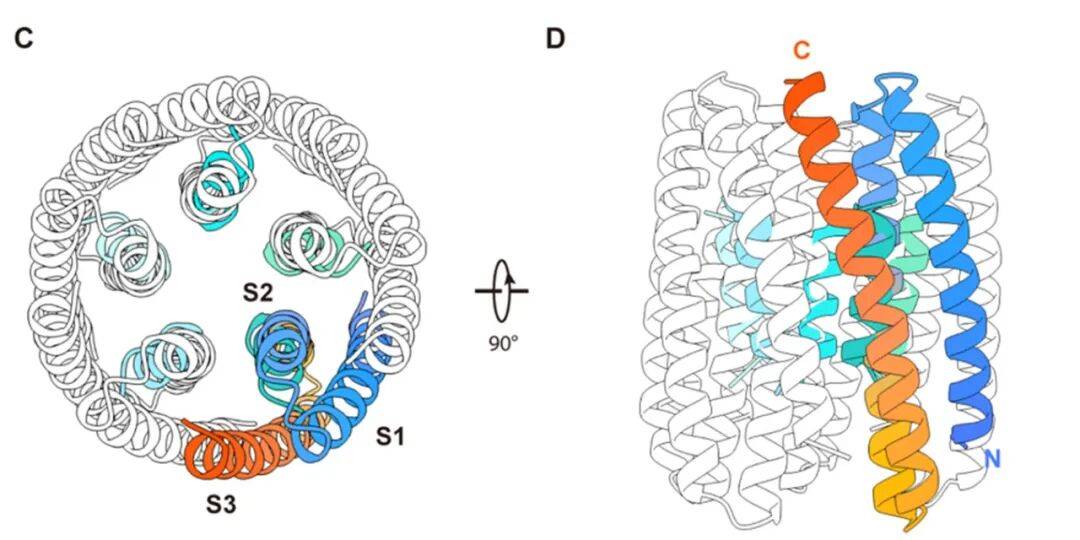
图 1. 从头设计 15 根 α 螺旋的五聚体跨膜蛋白
该设计的核心在于“闸机”的构建。研究团队创新性地在通道内部引入三层、共 15 个带正电的精氨酸,作为响应电压变化的“传感器”和筛选离子的“过滤器”。
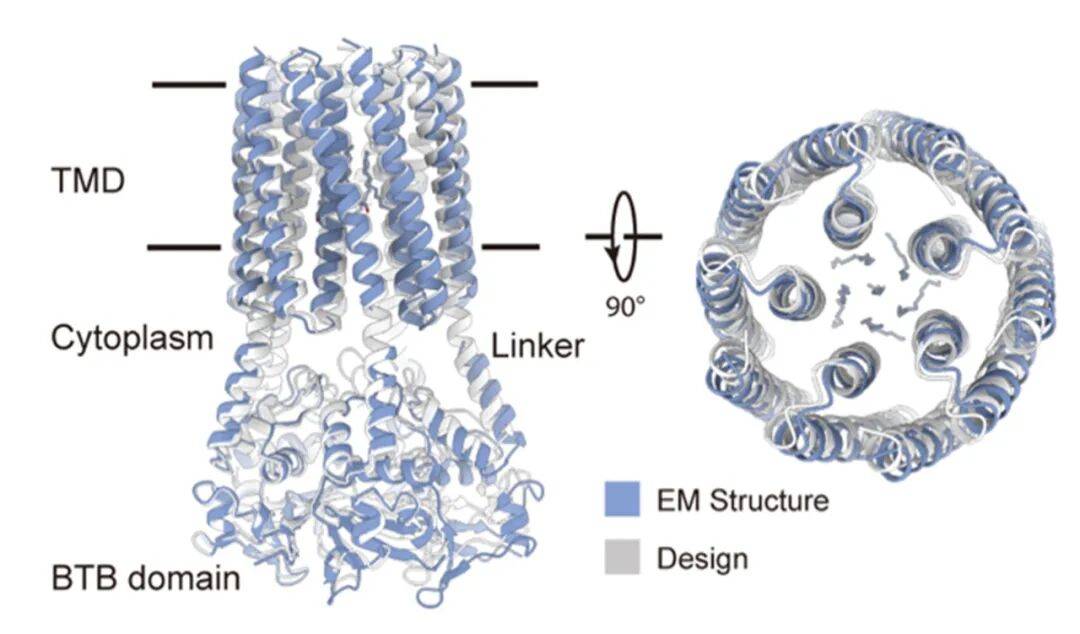
图 2. tmZC8-BTB 冷冻电镜结构与设计模型的比较
实验证实,当电压达到特定阈值(40 毫伏)时,该人工通道能被成功激活,选择性地允许阴离子通过。这一成果首次实现了对动态功能跨膜蛋白的精确设计,解决了该领域的长期挑战。
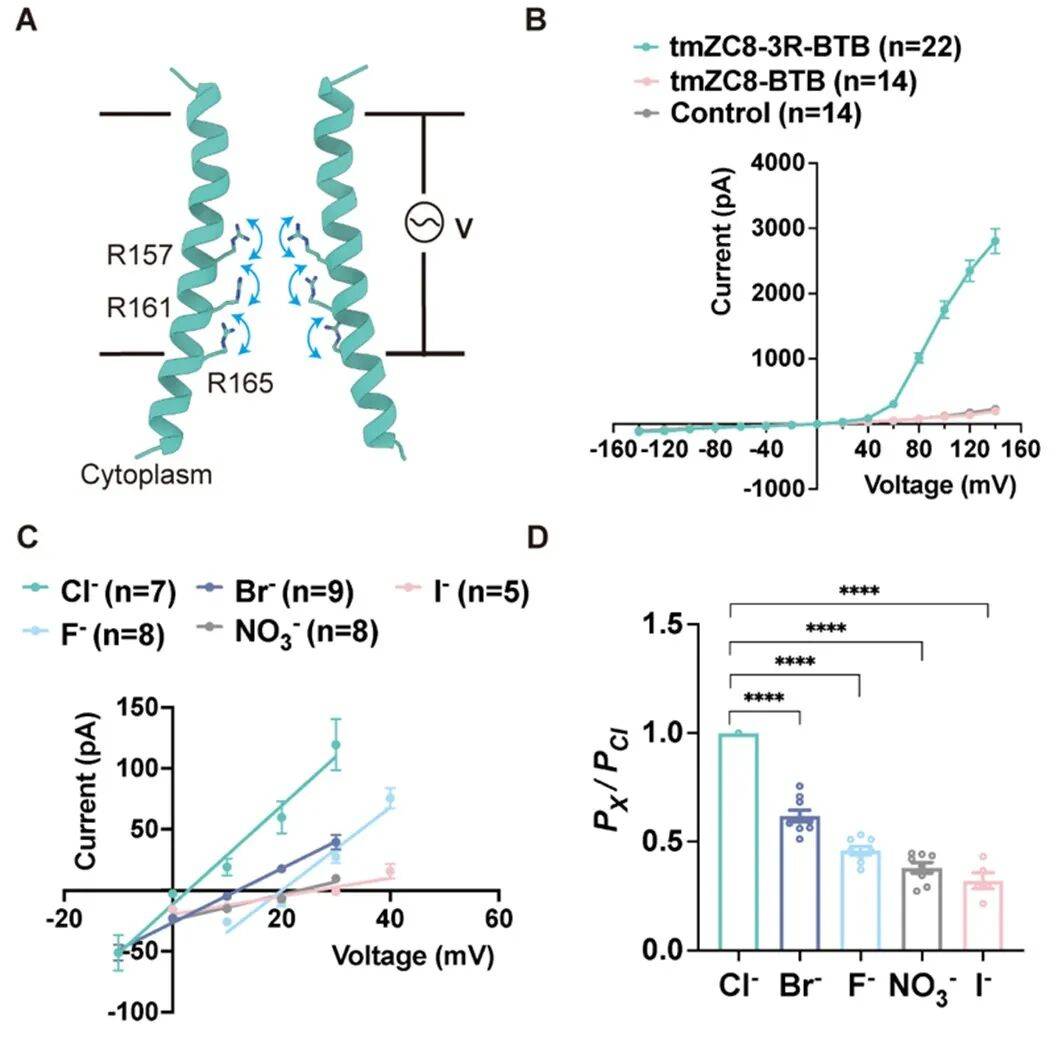
图 3. 从头设计电压门控阴离子通道及其电生理实验验证
更重要的是,该人工通道具备超越自然的“可调控性”。研究人员通过对关键氨基酸进行单点突变,成功将通道的激活电压从 40 毫伏降至更贴近生理条件的 20 毫伏,并能精确调整不同离子的通行优先级。这种“可编程”特性展示了从头设计的巨大潜力,使其有望成为灵活的科研工具。
为验证其生理功能,团队与神经生物学家合作,首次在国际上将从头设计的跨膜蛋白应用于活体动物实验。他们将人工通道蛋白注射到小鼠大脑中,成功观察到神经元的放电频率显著降低。
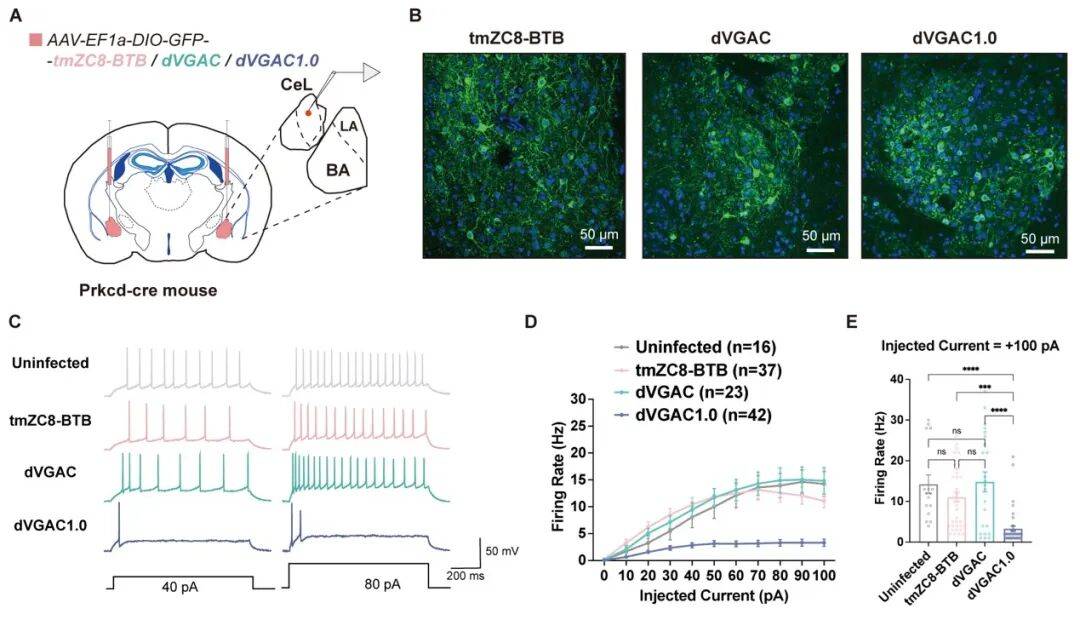
图 5. dVGAC1.0 抑制小鼠脑内神经元活动
这一结果证实,人工设计的离子通道“活”了,它能在复杂的生理环境中发挥作用,为未来开发针对神经系统疾病的新型蛋白质药物和精准疗法奠定了坚实基础。
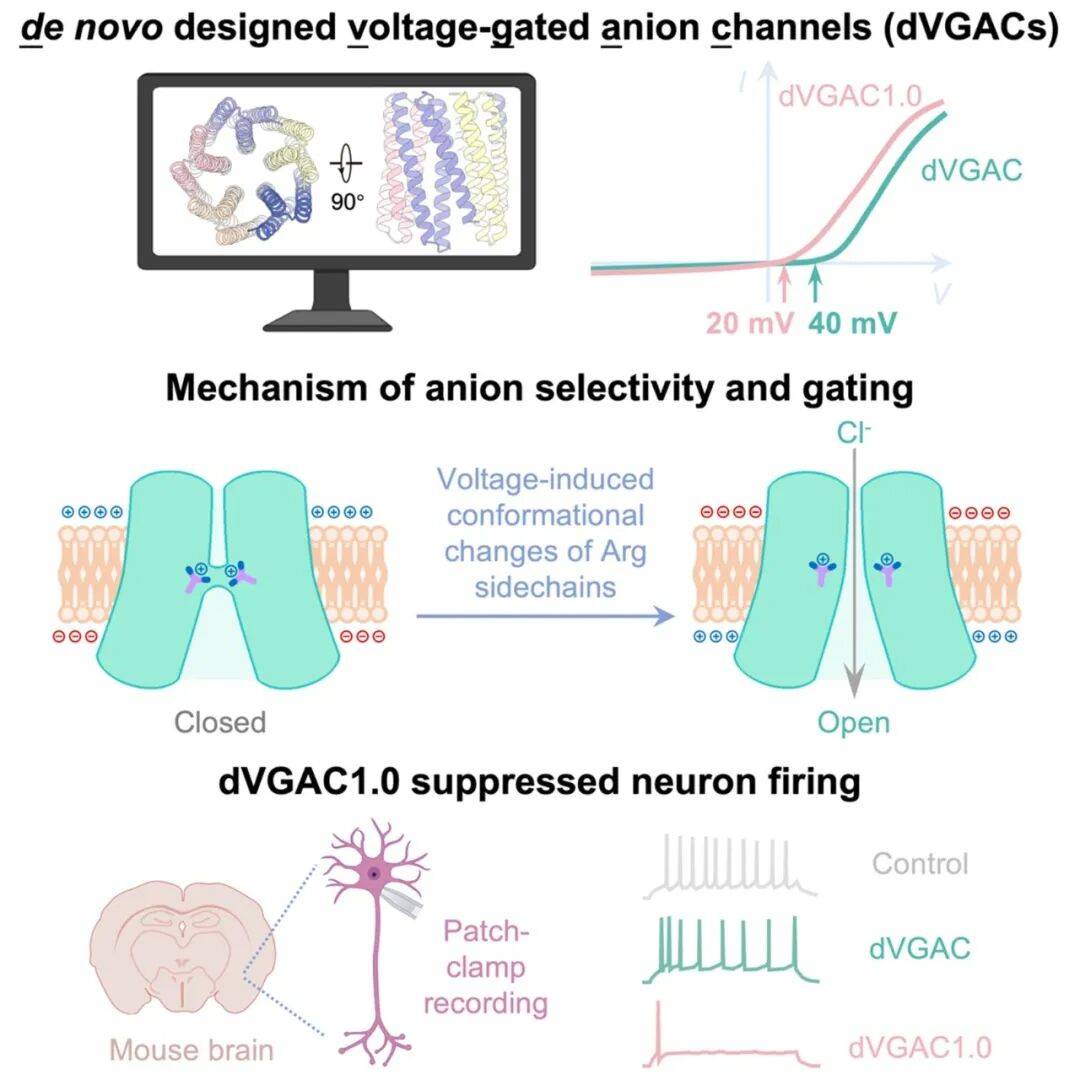
图 6. 从头设计可抑制小鼠脑内神经元活动的电压门控阴离子通道 dVGACs
IT之家附上参考地址
