Zeta电位:解锁药物研发稳定性的“电荷密码”
在创新药物研发领域,特别是纳米制剂(如脂质体、纳米乳、mRNA-LNP)、生物大分子药物(如多肽、蛋白质)以及复杂注射剂型中,胶体稳定性是决定产品开发成败、临床疗效与安全性的关键质量属性。颗粒聚集、沉淀等物理不稳定性,不仅导致研发资源浪费,更可能阻碍药物上市进程,甚至引发安全性风险。深入理解并有效调控分散体系的表面电化学性质,是解决这些稳定性挑战的核心。
Zeta电位作为表征颗粒表面电荷特性的关键物理化学参数,为预测和优化药物分散体系的稳定性提供了科学依据。可直接反映颗粒在分散介质中双电层结构的状态,其数值大小(绝对值)与体系的胶体稳定性存在明确的定量关联。
01Zeta 电位核心机制
Zeta 电位是衡量表面电位的指标,该电位是由于在胶体系统、悬浮液或乳液中的固-液或液-液界面形成双电层而产生的。当颗粒分散在液体中时,大多数颗粒会由于多种原因而携带表面电荷,包括表面基团的电离、差异离子吸附和差异离子溶解,这些都会在表面产生净电荷。固定的表面电荷倾向于从溶液中吸引带相反电荷的离子,从而在表面形成双电层。
因此,双电层分为两部分:内侧部分称为Stern层,具有更强吸附力的带相反电荷的离子;外侧部分称为扩散层,其中带相反电荷的离子在表面附近的溶液中排列,受到吸引力的作用,这些吸引力在一定程度上阻碍了这些离子向远离表面的方向扩散。这些离子与双电层外的溶液处于平衡状。
核心机制:颗粒表面电荷吸引反离子形成Stern层(强吸附)与扩散层(动态平衡),滑移面处的电位差即Zeta电位。
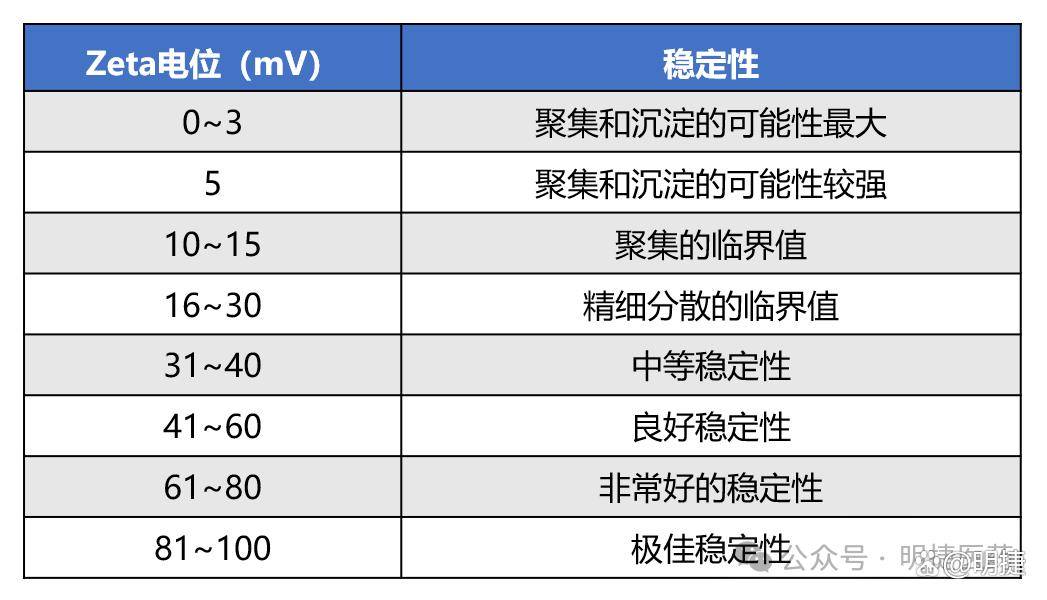
量化指标:|Zeta|>30 mV时体系高度稳定,<25 mV易聚集(如纳米药物沉淀)。
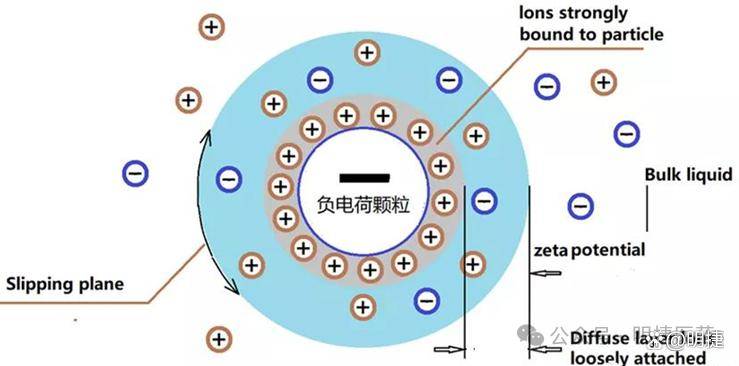
▲ 双电层模型与Zeta电位示意图
▼ Zeta电位和胶体稳定性关系表
02Zeta电位在药物研发中的核心应用
1.稳定性预测与优化
纳米制剂:脂质体、纳米乳等载药系统的Zeta电位调控可显著延长储存期(如β-榄香烯固体脂质纳米粒通过优化介质pH值提升稳定性)。
生物大分子:蛋白质制剂(如牛血清白蛋白)通过Zeta电位监测等电点(pH 5.07),避免聚集变性。
2.载药系统设计
载药量突破:研究发现Zeta电位与载药量呈正相关,米托蒽醌毫微粒载药量达46.77%。
靶向递送:羟基喜树碱肝靶向毫微粒通过吸附-包裹法调控表面电荷,实现精准肝组织分布。
3.工艺质量控制
处方筛选:pH、离子强度等参数对Zeta电位影响显著(如离子强度过高会压缩双电层,降低稳定性)。
生产监控:实时检测Zeta电位变化,预警纳米颗粒聚集风险,确保批次一致性。
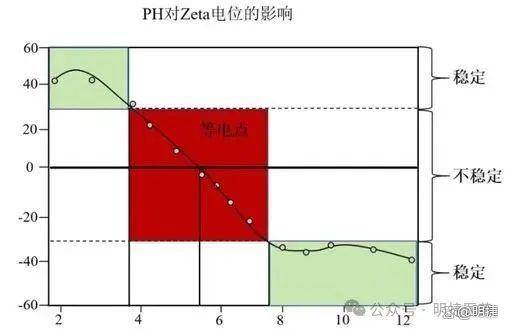
▲ pH对Zeta电位的影响
03Zeta电位全流程解决方案
复杂药物体系(如乳剂、含佐剂疫苗、高浓度蛋白溶液)在极端pH、高离子强度、特殊温度等条件下的Zeta电位精准测量,对仪器的灵敏度、分辨率和方法的稳健性提出了极高要求。
1-高精度测量技术
动态光散射技术(DLS):基于动态光散射技术,结合硬件PALS技术,检测灵敏度提高1000倍。
纳米库尔特技术(Nano Coulter):基于检测颗粒穿过纳米孔的时间(即电阻脉冲信号宽度),结合颗粒运动距离,计算电泳迁移率,进而根据Henry方程和Helmholtz-Smoluchowski模型准确计算zeta电位,可以实现单颗粒zeta电位分析
2-定制化方法开发
极端条件测试:涵盖pH 2–12、高温/低温、高盐等模拟制剂储存环境。
多模态分析:结合粒度分布、形貌表征、单颗粒性质表征、颗粒浓度表征等表征技术,提供全面稳定性评估。
合作赋能
从研发到生产的全周期支持
服务模块
方法开发与验证:针对复杂制剂(乳剂、脂质体、多肽、蛋白溶液)定制检测方案。
稳定性研究:加速实验与长期实验稳定性跟踪,预测货架期与聚集风险。
法规支持:符合ICH、USP等药典要求,提供申报所需完整数据包。
项目经验
司美格鲁肽注射液、羧基麦芽糖铁注射液、蛋白琥珀酸铁注射液、铝佐剂、mRNA疫苗LNP、VK1胶束等。
